川渝共建特色食品重庆市重点实验室,西南大学食品科学学院钟金锋博士近期在食品领域国际知名期刊《Food Hydrocolloids》(IF=9.147)在线发表了题为“Physicochemical properties and formation mechanism of whey protein isolate-sodium alginate complexes: Experimental and computational study”的研究论文,2019级硕士生刘祥雨为第一作者,西南大学覃小丽副教授、华南理工大学王永华教授参与了本研究的部分工作。

乳清分离蛋白因其营养价值丰富、易于获得、成本低廉等优点用于多种高蛋白质饮料的开发。然而,无涩味的高蛋白质饮料的pH一般控制在4.0–6.0左右,这与乳清蛋白分离物的等电点(pH 5.2)重叠。乳清蛋白在该pH范围下易于出现聚集和沉淀现象,使得高蛋白饮料的发展受到了一定的限制。海藻酸钠,一种天然的阴离子多糖,可与乳清分离蛋白形成可溶性复合物,增强体系中的静电斥力和空间位阻,对减少乳清分离蛋白的聚集和沉淀、提高其溶解度和稳定性,改善酸性蛋白饮料的品质具有重要意义。然而,目前很难从微观层面的实验分析结果中获取乳清分离蛋白和海藻酸钠在不同pH值下相互作用机理。因此,从分子水平阐明乳清分离蛋白-多糖复合物的形成机理,对准确调节乳清分离蛋白饮料的稳定性具有重要意义。
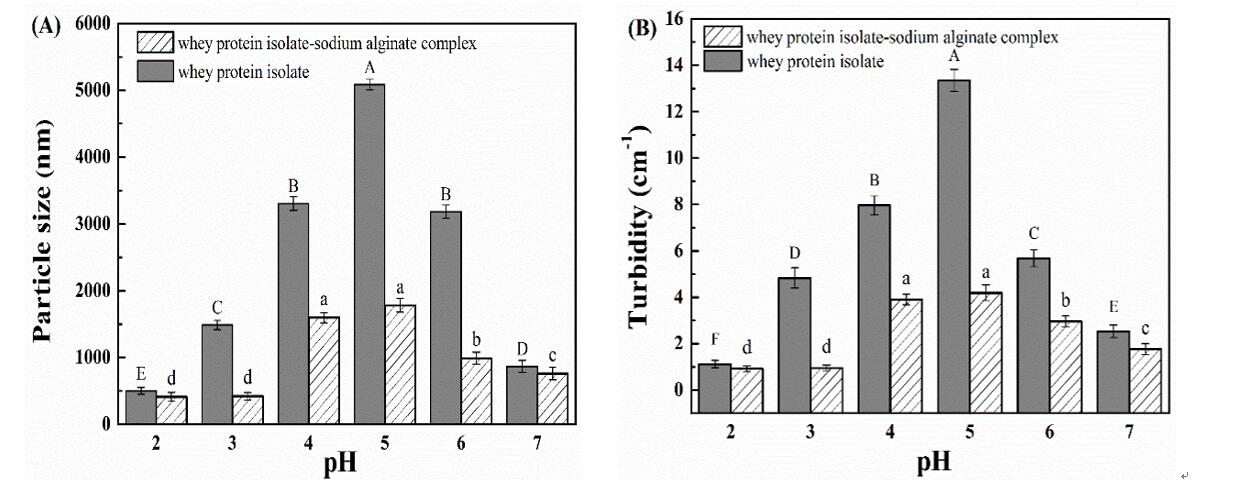
图1.乳清分离蛋白和乳清分离蛋白-海藻酸钠复合物在pH 2.0–7.0的粒径(A)和浊度(B)

图2. pH为2.0-7.0的乳清分离蛋白分散体(a-f)和存在海藻酸钠的乳清分离蛋白分散体(A-F)的荧光显微照片
在该研究中,以海藻酸钠作为稳定剂,研究在酸性条件下,海藻酸钠抑制乳清分离蛋白絮凝的结合机制,进而揭示乳清分离蛋白与多糖的相互作用机理。实验研究方面,首先通过粒径、浊度测量和荧光显微镜证实了海藻酸钠可抑制乳清分离蛋白在其等电点附近的凝聚(图1A、图1B和图2):当pH为5.0(接近等电点)时, 海藻酸钠的存在使复合物颗粒大小和浊度显著降低(分别降低65%和68.5%)。随后, 利用拉曼光谱确定了海藻酸钠的存在使乳清分离蛋白二级结构发生变化(图3A和图3B), pH为5.0时,其结构更加紧密, α-螺旋含量增加7.53%。
 图
图
3.乳清分离(A)和乳清分离蛋白-海藻酸钠复合物(B)在pH 2.0–7.0的拉曼光谱
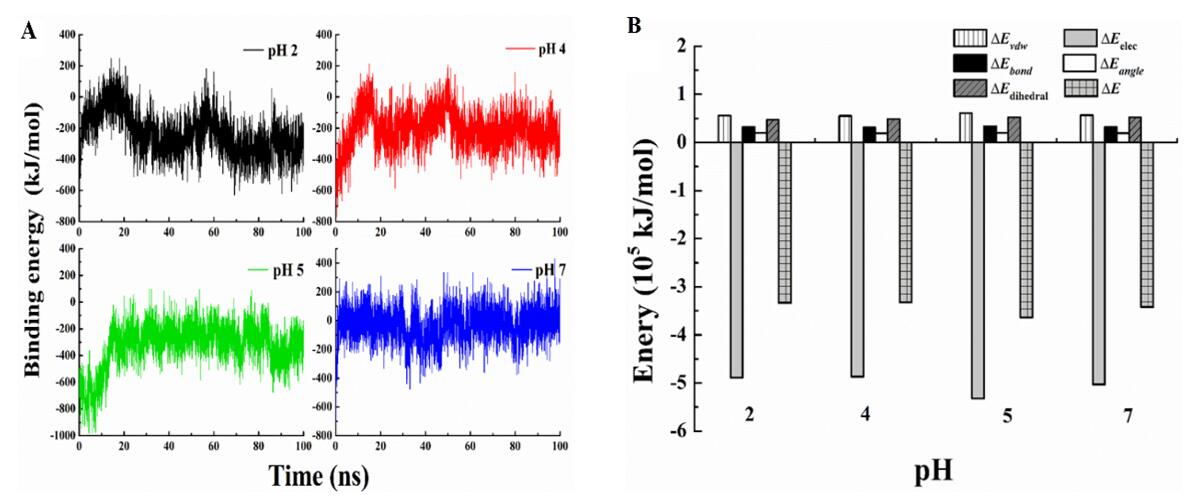
图4. β-乳球蛋白-海藻酸钠复合物在pH 2.0–7.0下的结合能(A)和能量贡献(B)
最后,通过密度泛函、分子对接、分子动力学模拟的计算方法探讨了不同pH值下乳清分离蛋白与海藻酸钠在分子水平上的相互作用和形成机理。静电势分析结果显示,海藻酸钠的-COOH和-OH最有可能与蛋白质相互作用。分子对接结果表明β-乳球蛋白的氨基酸残基与海藻酸钠的-COOH和-OH发生相互作用。分子动力学模拟分析表明,当pH值为5.0时,复合物的结合能相对较低(-338.17 kJ/mol), 静电相互作用在β-乳球蛋白-海藻酸钠复合物的形成中起主要作用(图4A和图4B)。上述结果表明海藻酸钠提高了乳清分离蛋白在等电点附近的稳定性,有助于开发物理稳定性更好的蛋白质产品,并在微观水平上提供其他蛋白质与多糖相互作用的信息。
原文链接: https://doi.org/10.1016/j.foodhyd.2022.107786
(钟金锋 供稿;孙康 校稿;曾亮、吴俊平 审稿 )